
Algunos padrones simples de reactividad química
Reacciones de combinación y descomposición
Las reacciones de combinación: tienen menos productos que reactantes:
El Mg se combina con el O2 para formar el MgO.
Las reacciones de descomposición: tienen menos reactantes que productos.
Reacción que sucede en un airbag
El NaN3 se descompuso para formar el Na y N2 (gaseosos)

Algunos padrones simples de reactividad química
Reacciones de combinación y descomposición

Factores físicos
Entre estos encontramos la temperatura, la presión, la energía lumínica (luz) y el área superficial.
La temperatura.
La velocidad de una reacción aumenta cuando se eleva la temperatura. Un huevo se cuece en menos tiempo al nivel del mar (donde el agua hierve a 100°c) que en la ciudad de México (donde la temperatura de ebullición es de 92°C).

Cuando aumenta la temperatura se incrementa la energía cinética molecular de las sustancias dando como consecuencia un mayor velocidad de la reacción.
La presión.
se produce cuando la reacción química existen gases en reactantes o en productos.al incrementarla la presión a los gases, su volumen disminuye por lo tanto la velocidad de la reacción de acelera, por ejemplo al cocinar alimentos en una olla de presión (presto).

La energía lumínica (luz)
La energía radiante tiene un efecto en la realización y velocidad de muchas reacción químicas.
la absorción de luz por una sustancia conduce a su excitación molecular afectando su velocidad y con frecuencia produce cambios químicos bajo condiciones donde la aplicación directa del calor no seria efectiva.
En estas reacciones, la velocidad se modifica al variar la intensidad de la luz incidente.

El área superficial.
Para que ocurra una reacción química, los reactivos deben entrar en contacto intimo, ósea, sus moléculas deben tocarse.
Si la reacción es con un solidó se efectúa mas rápido, pero si el solidó esta finalmente dividido (polvo) esto incrementa mas en su superficie de contacto.

Factores químicos
Los factores mas importantes son:
La naturaleza de los reactivos, la concentración de los reactivos, la presencia de catalizadores y la acidez o alcalinidad (ph).
La naturaleza de los reactivos.
No todas las reacciones se realizan a la misma velocidad, cada reacción tiene una velocidad determinada por la facilidad con la que sus reactivos pueden llevar a cabo el proceso químico en cuestión.
Un factor importante que afecta ala velocidad de una reacción química es la naturaleza reactiva de los reactantes.

Concentración de los reactivos.
El aumento de la concentración de los reactivos, suministra un mayor numero de moléculas reactivas que origina un incremento de la velocidad de reacción, la cual no permanece constante durante el proceso de transformación si no que decrece a medida que se consumen los reactivos.
La concentración de los reactivos influye decisiyamente en la velocidad de la reacción.

Catalizadores.
Desde fines del siglo pasado se descubrió que muchos procesos químicos y bioquímicas se llevan a cabo a diferente velocidad, dependiendo de su interacción con agentes externos a la reacción, llamados catalizadores.
Son sustancias que tienen la capacidad de acelerar o disminuir la rapidez con que se efectúa una reacción química.

Acidez o alcalinidad (PH)
El PH se usa para el control de algunas reacción que se realizan en laboratorios, industrias y centros de investigación, también tiene gran aplicación en medicina.
El PH de algunos alimentos es demasiado acido para algunas dietas.
Un cambio en el PH de la sangre es tan solo 0.4 unidades ocasionan la muerte.

Conclusión
Las reacciones químicas son dos o mas sustancias que se mezclan para formar una sustancia nueva.
El método del tanteo consiste en un balance de elementos que se efectúan en una ecuación química en el cual el mismo numero de elementos debe ser en productos y reactantes.
También existen los factores físicos y los factores químicos que intervienen en una reacción química como es la temperatura, la presión, entre otras (factores químicos); la acidez o alcalinidad (PH), presencia de catalizadores, entre otras (factores químicos).

Cálculo Estequiométrico

Cálculo Estequiométrico
Definición: es el cálculo de las cantidades de sustancias producidas o consumidas en una reacción química (leyes ponderales).
Importante: los coeficientes de una reacción química balanceada dan la relación molar entre las sustancias que participan de la reacción.
Ej.: La ecuación: 2H2(g) + O2(g) ? 2H2O(l), revela que 2 moles de 2H2(g) reaccionan con 1 mol de O2(g) formando 2 moles de 2H2O(l),.
Recordar: 1mol ? Massa molar (g) ? 6.02 x 1023
Gas (CNTP): 1mol ? 22.4L y PV = nRT

LAVOISIER: Ley de la Conservación de las Masas
C + O2 ? CO2
(Gp:) +
12g C + 32g O2 ? 44g CO2
Partículas iniciales y finales son las mismas ? masas iguales.
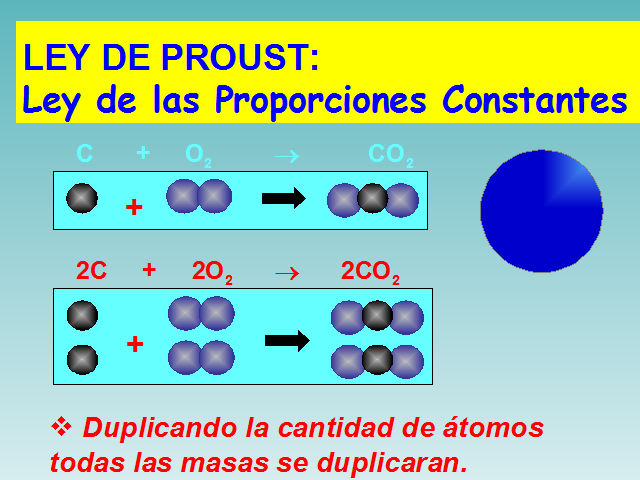
LEY DE PROUST: Ley de las Proporciones Constantes
C + O2 ? CO2
Duplicando la cantidad de átomos todas las masas se duplicaran.
(Gp:) +
(Gp:) +
2C + 2O2 ? 2CO2

Modelo de Cálculo:
Destacar la pregunta.
Identificar los reactantes y productos de la reacción.
Escribir la ecuación química y balancear.
Transformar los datos dados en cantidad de matéria (mol).
Calcular a través de la proporción estequiométrica de la reacción la cantidad de matéria (mol) de la(s) sustancia(s) solicitadas.
Transformar moles de la sustancia en la unidad solicitada.

Ejercício Modelo:
Cuantos gramos de oxígeno se necesitan para quemar 50 moles de monóxido de carbono?
1) m (g) O2 = ?
2) Reactantes: CO e O2 / Produtos: CO2
3) Reacción: 2CO + O2 ? 2CO2
4) datos: 50 moles de CO
5) 2 moles CO ___ 1 mol O2
50 moles CO ___ X moles O2 ? n = 25 moles O2
6) n = m / M ? 25 = m / 32 ? m = 800g de O2

Otros ejercicios:
1) Que masa , en gramos , de sulfato de sódio se obtiene por la neutralización de 20 moles de hidróxido de sódio, con ácido sulfúrico suficiente?
2) Cual es el volumen de amoniaco, en condiciones CNTP, obtenido en la síntesis directa apartir de 12g de hidrogeno y exceso de nitrogeno?
Grado de Pureza:
3) Cual es la masa de cloruro de cálcio que se obtiene cuando se trata 46.25g de hidróxido de cálcio, conteniendo 20% de impurezas, con ácido clorídrico suficiente?
4) En la quema de 30g de grafito, con 80% de pureza, cual es el volumen de CO2 obtenido en las CNTP?

Ejercícios:
Reactivo Limitante / Reactivo en exceso:
5) El H2S reacciona con el SO2 según la reacción :
2H2S + SO2 ? 3S + 2H2O
Cual es el número de moles de S, que se puede formar cuando reaccinan 5 moles de H2S con 2 moles de SO2?
6) Cromo metálico se puede producir por la reducción del Cr2O3 con aluminio según la ecuación:
2Al + Cr2O3 ? Al2O3 + 2Cr
Suponiendo reacción completa, la masa de cromo producida por la reacción de 5.4Kg de Al con 20Kg de Cr2O3, es:

Ejercicios:
Rendimiento:
7) La reacción entre cloruro de cálcio y nitrato de potasio presenta un rendimiento de 90%. Cual es la masa del precipitado obtenida a partir de 44.4g de CaCl2 ?
8) En la combustión de 36g de grafito puro se obtenieron 50.4L, en las CNTP, de CO2(g). Cual es el rendimiento de ese proceso?
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |
